浙江省杭州第二中学高三统测模拟考化学试题
浙江省杭州第二中学高三统测模拟考化学试题
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 I 127 Ba 137
选择题部分
一、选择题(本大题共 25 小题,每小题 2 分,共 50 分。每个小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1. 已知 H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,则下列说法正确的是
A. H3PO2属于二元酸 B. H3PO2属于三元酸
C. NaH2PO2属于酸式盐 D. NaH2PO2属于正盐
2. 下列仪器中名称正确且应放在石棉网上加热的是( )
A.  表面皿 B.
表面皿 B.  坩埚 C.
坩埚 C.  蒸馏烧瓶 D.
蒸馏烧瓶 D. 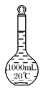 容量瓶
容量瓶
3. 下列反应与 Br2+SO2+2H2O=H2SO4+2HBr 相比较,水的作用不相同的是
A. 2Na2O2+2H2O=4NaOH+O2↑ B. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 3NO2+H2O=2HNO3+NO D. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
4. 下列说法不正确的是
A. 冰醋酸和水银都是纯净物 B. 氢原子和重氢原子是两种不同核素
C. 氯化钠固体和液氨都是电解质 D. 稀硫酸和氢氧化铜悬浊液都属于分散系
5. 下列常见物质的俗名或主要成份与化学式或结构简式相对应的是
A. 苏打——NaHCO3 B. 生石膏——2CaSO4·H2O C. 重晶石——BaCO3 D. 石炭酸——  OH
OH
6. 下列化学用语正确的是
A. 聚丙烯的结构简式: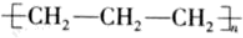
B. 丙烷分子的比例模型: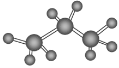
C. 甲醛分子的电子式: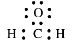
D. 2-乙基-1,3-丁二烯分子的键线式:
7. 下列有关表述中正确的一组是
A. 过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)互为同分异构体
B.  和
和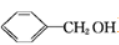 互为同系物
互为同系物
C. 16O2与18O2互为同位素
D. H O、D
O、D O、H
O、H O、D
O、D O 互为同素异形体
O 互为同素异形体
8. 证据推理与模型认知是化学学科的核心素养之一。下列事实与相应定律或原理不相符的是( )
A. 向Fe(SCN)3溶液中加入少量KSCN固体,溶液颜色加深——勒夏特列原理
B. 常温常压下,1体积CH4完全燃烧消耗2体积O2——阿伏加德罗定律
C. 向漂白液中加入少量稀硫酸能增强漂白液的漂白效果——元素周期律
D. 通过测量C、CO的燃烧热来间接计算2C(s)+O2(g)=2CO(g)的反应热——盖斯定律
9. 下列说法正确的是
A. 硫酸铜是可用于饮用水的消毒
B. 氯化亚铁溶液与铜反应可用于制作印刷电路板
C. SiO2 可用于制作光导纤维,也可以制成光电池
D. 纯碱可用于玻璃、肥皂、造纸、食品等工业
10. 下列关于有机物的说法不正确的是
A. 苯和乙烯均可以使溴水褪色,但褪色原理不同
B. 乙醇能发生取代反应、氧化反应、消去反应
C. 分子式为 C5H12 的有机物,同分异构体有 3 种
D. 在制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余
11. 下列实验有关操作正确的是
A. 只有有色离子的检验才能用纸层析法,否则无法看到色斑
B. 在制取“摩尔盐”的实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
C. 在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸后,即可判断火柴头中有氯离子的存在
D. 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用碳酸氢钠或饱和硼酸溶液洗,最后用水冲洗, 并视情况作进一步处理
12. 以下关于铝及其化合物性质的描述中不正确的是
A. 铝不易被空气腐蚀是因为不会与氧气发生反应
B. 铝热反应可用于焊接铁轨
C. 氢氧化铝是一种两性氢氧化物
D. 铝元素是地壳中含量最多的金属元素
13. 下列离子方程式正确的是
A. 碳酸氢钠溶液中加入氢氧化钠溶液:HCO +OH-=CO2+H2O
+OH-=CO2+H2O
B. 向 Fe(OH)3 中加入氢碘酸溶液:Fe(OH)3+3H+= Fe3++3H2O
C. Na2S2O3 与稀 H2SO4 混合:S2O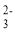 +2H+= S↓+SO2↑+H2O
+2H+= S↓+SO2↑+H2O
D. 铜和浓硝酸反应:3Cu+8H++2NO =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
14. 下列说法不正确的是
A. 除去油脂中的少量水分,既可以用无水硫酸钠也可以用碱石灰
B. 淀粉和纤维素在一定条件下都可转化为乙醇
C. 氨基酸之间能发生反应生成多肽,构成蛋白质
D. 蛋白质在加热、重金属盐等作用下会发生变性
15. Y 是合成药物查尔酮类抑制剂的中间体,可由 X 在一定条件下反应制得。下列叙述不正确的是

A. 该反应为取代反应
B. Y 能使酸性高锰酸钾溶液褪色可证明其分子中含有碳碳双键
C. X 和 Y 均能发生银镜反应
D. 等物质的量的 X、Y 分别与 H2 反应,最多消耗 H2 的物质的量之比为 4∶5
16. 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍。下列叙述正确的是
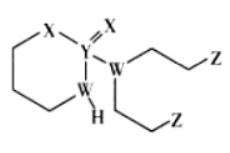
A. 元素的非金属性:W>Z>X
B. Y的最高价氧化物的水化物是强酸
C. W的最简单氢化物与Z的单质混合后可产生白烟
D. Y、Z形成的化合物中,每个原子均满足8电子结构
17. 某温度下,测得蒸馏水 pH=6,以下过程均在该温度下发生。下列说法中正确的是
A. 某溶液中水电离出的 c(H+)=1.0×10−12 mol· L−1,其 pH 一定是 12
B. 向氨水中通入 CO2,随着 CO2 的通入,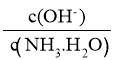 不断增大
不断增大
C. 取 pH=5.5 的盐酸 100 mL,加水稀释到 1L,则溶液 pH 变为 6.5
D. pH 为 2 的 NaHSO4 与等体积 pH=10 的 NaOH 溶液充分反应后恰好呈中性
18. 锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是
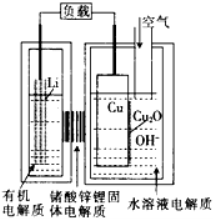
A. 放电时,当电路中通过0.2mol电子的电量时,有0.2mol Li+透过固体电解质向Cu极移动,有标准状况下1.12L氧气参与反应
B. 通空气时,铜被腐蚀,表面产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
D. 整个反应过程,空气中的O2起了催化剂的作用
19. 下列说法正确的是( )
A. MgF2中的两种离子核外排布相差一个电子层
B. 石英和硫磺晶体熔化时克服相同类型的微粒间作用力
C. 发生物理变化时物质中的化学键也可能被破坏
D. H2O和H2O2的稳定性不同是因为微粒间作用力不同
20. 设NA为阿伏加德罗常数的值,下列说法正确的是
A. pH=1的硫酸溶液1L,溶液中含SO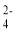 的数目等于0.1NA
的数目等于0.1NA
B. 60gSiO2晶体中Si-O键数目为2NA
C. 10mL0.1mol/L的FeCl3与20mL0.1mol/LKI溶液反应,转移电子数为0.001NA
D. 真空密闭容器中充入0.1molH2和0.1molI2充分反应后,容器内分子总数为0.2NA
21. 已知:A(g)+3B(g)⇌2C(g)。起始反应物为A和B,物质的量之比为1:3,且总物质的量不变,在不同压强和温度下,反应达到平衡时,体系中C的物质的量分数如下表:下列说法不正确的是( )
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
40MPa | 0.549 | 0.429 | 0.322 | 0.169 |
A. 压强不变,降低温度,A的平衡转化率增大
B. 在不同温度下、压强下,平衡时C的物质的量分数可能相同
C. 达到平衡时,将C移出体系,正、逆反应速率均将减小
D. 为提高平衡时C的物质的量分数和缩短达到平衡的时间,可选择加入合适的催化剂
22. 卤化铵(NH4X)的能量关系如图所示,下列说法正确的是()
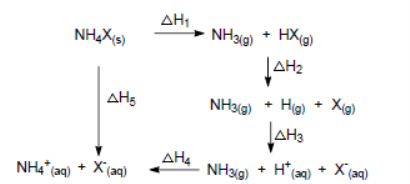
A. ΔH1>0,ΔH2<0 B. 相同条件下,NH4Cl的ΔH2比NH4I的小
C. 相同条件下,NH4Cl的ΔH3比NH4I的小 D. ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
23. 常温下,向1 L 0.1 mol/L H2A溶液中逐渐加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数和溶液pH的关系如图所示,则下列说法中正确的是

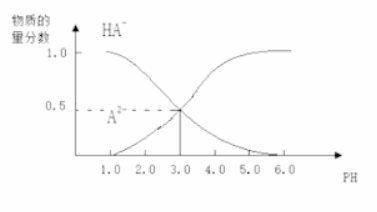
A. H2A的电离方程式为:H2A H++HA- ,HA-
H++HA- ,HA- H++A2-
H++A2-
B. 0.1 mol/L NaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. pH=4.0时,图中n(HA-)约为0.0091 mol
24. 实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)[Fe2(OH)n(SO4)3-0.5n]m和绿矾FeSO4·7H2O,其过程如图所示,下列说法不正确的是

A. 炉渣中FeS与硫酸、氧气反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S+6H2O
B. 溶液Z加热到70~80 ℃的目的是促进Fe3+的水解
C. 溶液Y经蒸发浓缩、冷却结晶、过滤等步骤可得到绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若pH偏小导致聚铁中铁的质量分数偏大
25. 某溶液可能含有下列离子的某几种:Cl-、I-、SO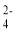 、CO
、CO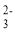 、Na+、NH
、Na+、NH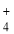 、Fe3+、Fe2+和Ba2+,且所含离子的浓度均相等。某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知,下列说法正确的是
、Fe3+、Fe2+和Ba2+,且所含离子的浓度均相等。某同学为了确认其成分,取部分试液,设计并完成了如下实验:由此可知,下列说法正确的是

A. 原溶液中Fe3+和Fe2+可能都存在
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)=0.2mol/L
C. SO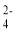 、NH
、NH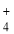 、Fe2+一定存在,CO
、Fe2+一定存在,CO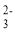 、Ba2+一定不存在
、Ba2+一定不存在
D. 若要进一步确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入足量酸性高锰酸钾溶液,若溶液紫红色褪去,则证明原溶液中有Fe2+
非选择题部分
二、非选择题(本大题共 6 小题,共 50 分)
26. (1)1mol 高聚物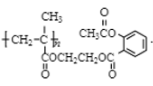 与足量NaOH溶液反应,最多可消耗NaOH_____mol
与足量NaOH溶液反应,最多可消耗NaOH_____mol
(2)酯可与水发生水解反应,也可以与醇发生跟水解反应类似 醇解反应。请写出丙烯酸乙酯CH2=CHCOOCH2CH3 与 CH318OH 发生醇解的化学方程式_____
醇解反应。请写出丙烯酸乙酯CH2=CHCOOCH2CH3 与 CH318OH 发生醇解的化学方程式_____
27. (为测定无水Cu(NO3)2产品的纯度,可用分光光度法。已知:4NH3·H2O + Cu2+ = Cu(NH3) +4H2O;Cu(NH3)
+4H2O;Cu(NH3) 对特定波长光的吸收程度(用吸光度 A 表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)2+的吸光度A与Cu2+标准溶液浓度关系如图所示:
对特定波长光的吸收程度(用吸光度 A 表示)与 Cu2+在一定浓度范围内成正比。现测得Cu(NH3)2+的吸光度A与Cu2+标准溶液浓度关系如图所示:
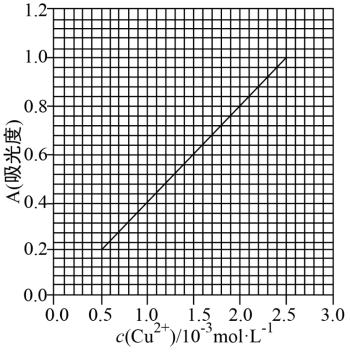
准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度 A=0.620,则无水Cu(NO3)2产品的纯度是_____(以质量分数表示,保留三位有效数字),写出必要的过程。
28. 化合物 A 由三种短周期元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为 672 mL;固体甲为常用的耐火材料,溶液乙为建筑行业中常用的粘合剂。请回答下列问题:
(1)A 的组成元素为_____(用元素符号表示),A 的化学式为_____;
(2)写出气体甲与 NaOH(aq)反应 离子方程式_____
离子方程式_____
(3)往溶液乙中通入少量 CO2气体发生的化学方程式_____;
(4)高温下A 与足量氯气能发生剧烈爆炸,生成三种常见化合物,试写出相应的化学方程式_____。
29. 乙炔是一种重要 化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在 25℃、 101 kPa 时),CH4、C2H4在高温条件还会分解生成炭与氢气:
化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在 25℃、 101 kPa 时),CH4、C2H4在高温条件还会分解生成炭与氢气:
①C(s) +2H2(g) CH4(g) ΔH1=-74.85kJ•mol-1
CH4(g) ΔH1=-74.85kJ•mol-1
②2CH4(g) C2H4(g) +2H2(g) ΔH2=+340.93kJ•mol-1
C2H4(g) +2H2(g) ΔH2=+340.93kJ•mol-1
③C2H4(g) C2H2(g) +H2(g) ΔH3=+35.50kJ•mol-1
C2H2(g) +H2(g) ΔH3=+35.50kJ•mol-1
请回答:
(1)依据上述反应,请写出 C 与 H2化合生成 C2H2的热化学方程式_____。
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。图 1 为乙炔产率与进料气中 n(氢气)/n(乙烯)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是_____。

(3)图 2 为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。
①乙炔体积分数在 1530℃之前随温度升高而增大的原因可能是_____;1530℃之后,乙炔体积分数增加不明显的主要原因可能是_____。
②在体积为 1L 的密闭容器中反应,1530℃时测得气体的总物质的量为 1.000 mol,则反应 C2H4(g) C2H2(g) +H2(g) 的平衡常数 K=_____。
C2H2(g) +H2(g) 的平衡常数 K=_____。
③请在图 3 中绘制乙烯的体积分数和反应温度的关系曲线______

30. 二草酸合铜( II )酸钾晶体{K2[Cu(C2O4)2]· 2H2O},微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。
(Ⅰ)用氧化铜和草酸为原料制备二草酸合铜(II)酸钾晶体的流程如下:

已知:H2C2O4 CO↑+CO2↑+H2O。回答下列问题:
CO↑+CO2↑+H2O。回答下列问题:
(1)将 H2C2O4晶体加入去离子水中,微热,溶解过程中温度不能太高,原因是_____。
(2)将 CuO 与 KHC2O4 混合液在 50°C 下充分反应,该反应的化学方程式为_____。
混合液在 50°C 下充分反应,该反应的化学方程式为_____。
(3)50 °C 时,加热至反应充分后的操作是_____(填字母)。
A 放于冰水中冷却后过滤 B 自然冷却后过滤 C 趁热过滤 D 蒸发浓缩、冷却后过滤
(Ⅱ)以CuSO4· 5H2O 晶体和 K2C2O4固体为原料制备二草酸合铜( II )酸钾晶体。
实验步骤:将 CuSO4· 5H2O 晶体和 K2C2O4固体分别用去离子水溶解后,将 K2C2O4溶液逐滴加入硫酸铜溶液中,有晶体析出后放在冰水中冷却,过滤,用酒精洗涤,在水浴锅上炒干。炒时不断搅拌,得到产品。
(4)用酒精而不用冷水洗涤的目的是_____
(Ⅲ)产品纯度的测定:准确称取制得的晶体试样 ag 溶于 NH3·H2O 中,并加水定容至 250mL,取试样溶液 25.00mL,再加入 10 mL 的稀硫酸,用 b mol· L-1的 KMnO4标准液滴定,消耗 KMnO4标准液 V mL。
(5)滴定时,下列滴定方式中,最合理的是_____(填字母)。 (夹持部分略去)
A 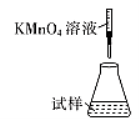 B
B 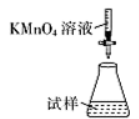 C
C 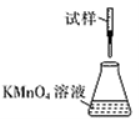
(6)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果会_____(填“偏大”偏小”或“无影响”)。
31. 乙基丹皮酚肟胺基醇醚衍生物(H)具有很好的抗血小板聚集活性,是良好的心脑血管疾病的治疗药物。

已知:①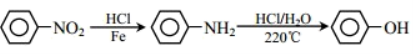
②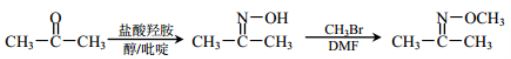
③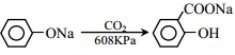
请回答:
(1)E 中含有 官能团名称为_______
官能团名称为_______
(2)丹皮酚的结构简式为_____;
(3)下列说法不正确的是_______
A 乙基丹皮酚肟胺基醇醚衍生物 H 的分子式为 C21H34O3N3
B 物质B可能溶于水,且能与盐酸反应生成有机盐
C D→E 和 G→H 的反应类型均为取代反应
D 物质 C 能使浓溴水褪色,而且 1mol C 消耗 4molBr2
(4)写出 F→G 的化学方程式_____。
(5)写出满足下列条件 的所有同分异构体的结构简式_____。
的所有同分异构体的结构简式_____。
①含有六元含氮杂环;②无 N-N 键;③1H-NMR 谱显示分子中含有 4 种氢原子。
(6)阿司匹林也具有抑止血小板凝聚的作用。结合题给信息,请以硝基苯和乙酸酐为原料设计合理的路线制备阿司匹林(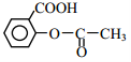 )。(用流程图表示,无机试剂任选)_____。
)。(用流程图表示,无机试剂任选)_____。
 浙江2023年高考是哪天 什么时候高考
浙江2023年高考是哪天 什么时候高考 浙江高考结束时间2023 具体几号结束
浙江高考结束时间2023 具体几号结束 2023年浙江高考什么时候开始 几号开始高考
2023年浙江高考什么时候开始 几号开始高考 2023浙江高考准考证打印截止时间及入口 什么时候打印准考证
2023浙江高考准考证打印截止时间及入口 什么时候打印准考证 2023年浙江高考准考证打印入口官网 在哪里打印准考证
2023年浙江高考准考证打印入口官网 在哪里打印准考证 浙江2023年高考具体时间安排 高考科目顺序
浙江2023年高考具体时间安排 高考科目顺序 2023年浙江几号高考 高考时间是什么时候
2023年浙江几号高考 高考时间是什么时候 浙江高考试题及答案各科汇总 所有试题解析
浙江高考试题及答案各科汇总 所有试题解析 浙江高考生物试题及答案汇总 生物试题解析
浙江高考生物试题及答案汇总 生物试题解析 浙江高考化学试题及答案汇总 化学试题解析
浙江高考化学试题及答案汇总 化学试题解析 浙江高考物理试题及答案汇总 物理试题解析
浙江高考物理试题及答案汇总 物理试题解析 浙江高考地理试题及答案汇总 地理试题解析
浙江高考地理试题及答案汇总 地理试题解析 浙江高考历史试题及答案汇总 历史试题解析
浙江高考历史试题及答案汇总 历史试题解析 浙江高考政治试题及答案汇总 政治试题解析
浙江高考政治试题及答案汇总 政治试题解析 浙江高考英语试题及答案汇总 英语试题解析
浙江高考英语试题及答案汇总 英语试题解析 坩埚 C.
坩埚 C.  蒸馏烧瓶 D.
蒸馏烧瓶 D. 







 与足量NaOH溶液反应,最多可消耗NaOH_____mol
与足量NaOH溶液反应,最多可消耗NaOH_____mol




 B
B  C
C 

 的所有同分异构体的结构简式_____。
的所有同分异构体的结构简式_____。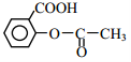 )。(用流程图表示,无机试剂任选)_____。
)。(用流程图表示,无机试剂任选)_____。